AmerLab – Warszawa – Laboratorium – diagnostyka chorób pasożytniczych i odzwierzęcych. Badanie kleszczy – ciekawa oferta (neoehrlichia, rickettsia, anaplasma, babesia, borelia), bartonella) .Microsporydia (grupa grzybów wewnątrzkomórkowych wywołujących chroniczne biegunki i inne inwazje)
Archiwum kategorii: Bez kategorii
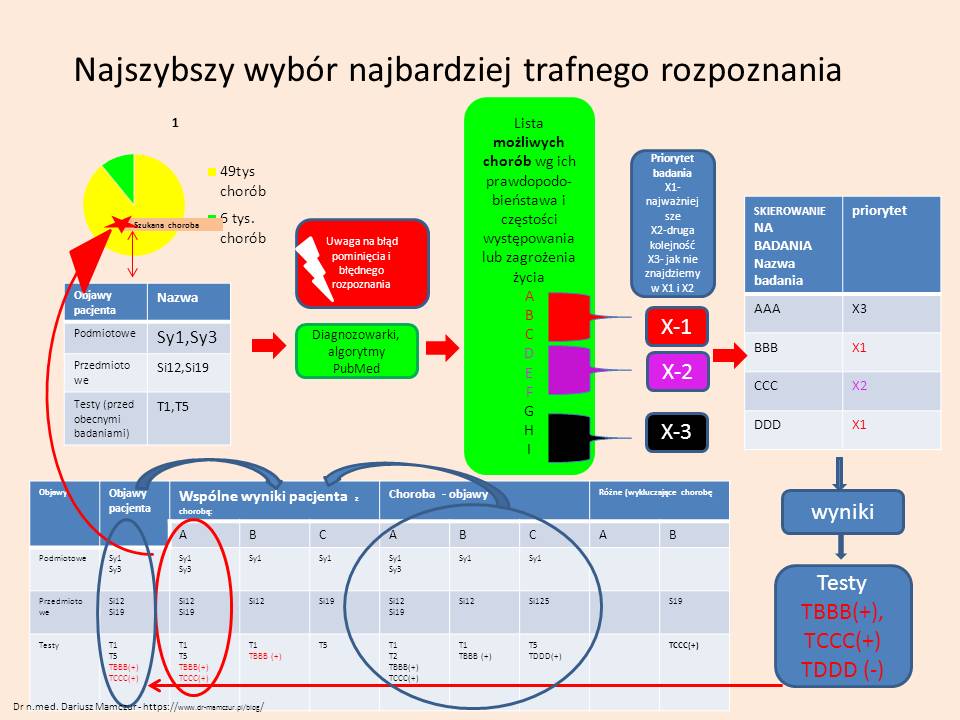
Najszybszy wybór trafnego rozpoznania
Zbieramy wywiad od pacjenta uwzględniający odchylenia w badaniu przedmiotowym, dotychczas wykonanych badaniach dodatkowych. Na tej podstawie szukamy wszystkich podobnych chorób.
Po stworzeniu listy chorób uporządkowanej kolorystycznie (czerwony najczęstsze, najbardziej prawdopodobne lub zagrażający życiu, fiolet – mniej prawdopodobne, czarne- rzadkie, mało prawdopodobne, ale możliwe) (pamiętając, że tworząc listę możemy zrobić błąd z pominięcia w różnicowanej choroby oraz wybrać źle ostateczne rozpoznanie podczas oceny różnicowania) – tworzymy listę diagnostyczną wg priorytetów (odpowiadających kolorystycznej randze chorób) X-1, X2, X-3 . testy wstawiamy do tabeli DDx i wybieramy najbardziej prawdopodobną jednostkę chorobowa (pamiętając, że testy ją wykluczające muszą być ujemne).
DDx a błąd diagnostyczny
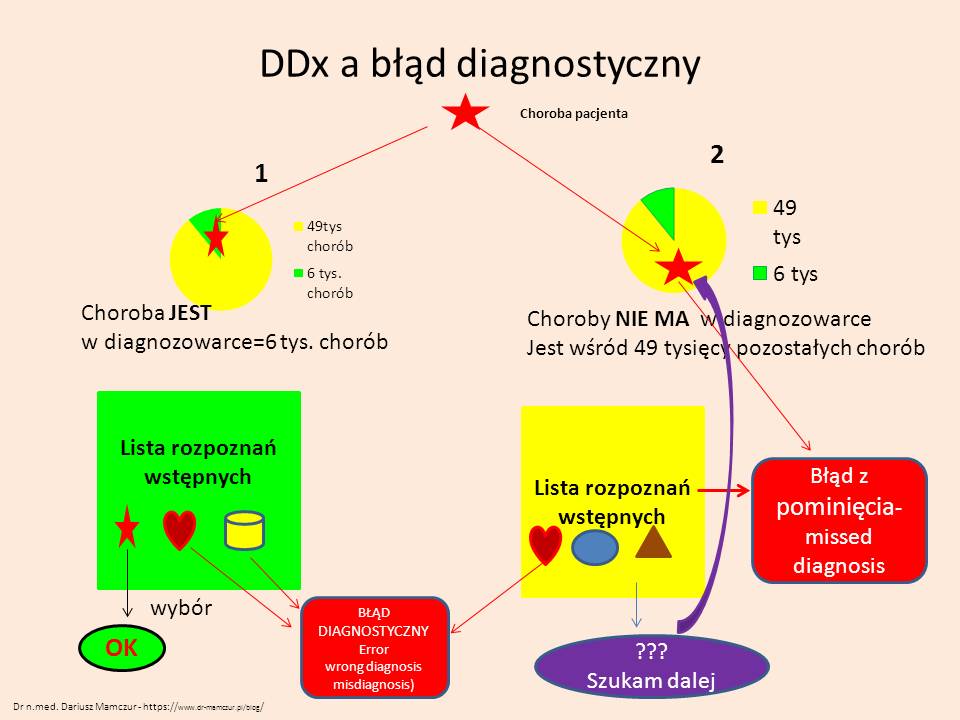 W literaturze anglojęzycznej można spotkać się z opisem błędów diagnostycznych- nazywane są m. in. misdiagnosis (błędne rozpoznanie) i missed diagnosis (pominięte rozpoznanie).
W literaturze anglojęzycznej można spotkać się z opisem błędów diagnostycznych- nazywane są m. in. misdiagnosis (błędne rozpoznanie) i missed diagnosis (pominięte rozpoznanie).
Stosując w diagnostyce różnicowej “diagnozowarki” symptomatyczne należy zdawać sobie sprawę z ograniczeń tych narzędzi. Należy wcześniej wiedzieć, ile chorób ma w swojej bazie takie narzędzie. Np. Isabel – to ok. 6 tysięcy chorób. Pamiętamy, że chorób w ICD jest około 55 tysięcy . Jeśli nasza choroba jest w pozostałych 49 tysiącach, to stosując takie narzędzie – pominiemy w DDx chorobą pacjenta, lub możemy błędnie wybrać inną chorobę wylistowaną w naszym narzędziu. Jeśli wykażemy czujność diagnostyczną – będziemy szukać dalej. Może się okazać, że choroba z listy bardzo przypomina objawami chorobę pacjenta i wybierzemy niewłaściwe rozpoznanie. Takim sygnałem może się okazać brak skuteczności leczenia chorego. Może zdarzyć się jednak paradoksalna sytuacja – pacjent mimo złej diagnozy zareaguje na nasze leczenie. Najczęściej zdarza się t przy stosowaniu antybiotyków o szerokim spektrum – leczymy np. gronkowa, a wyleczymy tak na prawdę chlamydię.
Budowanie listy chorób do DDx
Listę chorób możemy stworzyć używając “diagnozowarek” wg objawów chorego lub algorytmów diagnostycznych.
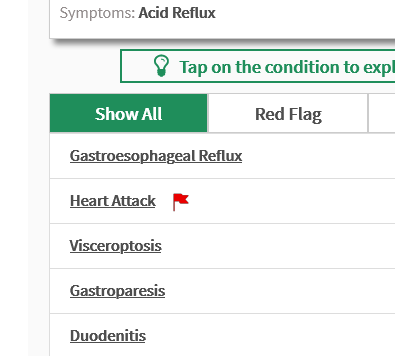
Jeśli uznamy, że lista jest zbyt wąska – warto skorzystać z listy chorób podawanych w podręcznikach medycznych w dziale rozpoznanie różnicowe np. dla choroby refluksowej przełyku
Podobnie możemy postąpić podejrzewając,, że dotychczasowe rozpoznanie choroby pacjenta jest nieprawidłowe (wrong diagnosis, mis diagnosis). Odszukujemy opis choroby ze złym rozpoznaniem i uwzględniamy choroby, które powinno się uwzględnić w diagnostyce różnicowe (j.w.). Niestety zniknęła bezpłatna, ciekawa strona wrongdiagosiss.com.
Przydatne też są listy piśmiennictwa (Refereces i similar articles) w artykułach naukowych -np. Medline na PubMed
Choroba Fabrye’go – test suchej kropli krwi
Na stronie Medycyny Praktycznej stworzono możliwość bezpłatnego otrzymania TESTU SUCHEJ KROPLI KRWI w kierunku choroby Fabrye’go i Pompego u pacjentów z niewyjaśnionym przerostem mięśnia sercowego
“Jak wykonać test suchej kropli krwi?”
Warto też przeczytać
Jakie czynniki mogą wpływać na uzyskiwane efekty zdrowotne u chorych na chorobę Fabry’ego stosujących enzymatyczną terapię zastępczą?
Manifestacja choroby Fabry’ego u młodych chorych z udarem niedokrwiennym mózgu
Skala FASTEX w ocenie progresji objawów choroby Fabry’ego
Warto też zobaczyć Sen lekarza
Objawy liczne i rozproszone narządowo w trudnych przypadkach diagnostycznych.
Analizując pacjentów, którzy nie mogą znaleźć rozpoznania swojej choroby często spotykam się z osobami, które zgłaszają lekarzom po kilkanaście, a nawet kilkadziesiąt różnych dolegliwości (Przykładowo ostatnia chora zgłosiła mi 59 objawów z 5 układów) Taka prezentacja problemu jest olbrzymim problemem dla lekarza przyjmującego pacjentów ambulatoryjnych.
Po pierwsze takiemu choremu trzeba poświęcić co najmniej 1 do 2 godzin na zebranie wywiadu i zapoznanie się z dotychczasowymi wynikami (lekarz POZ ma około 10 minut na wizytę pacjenta).
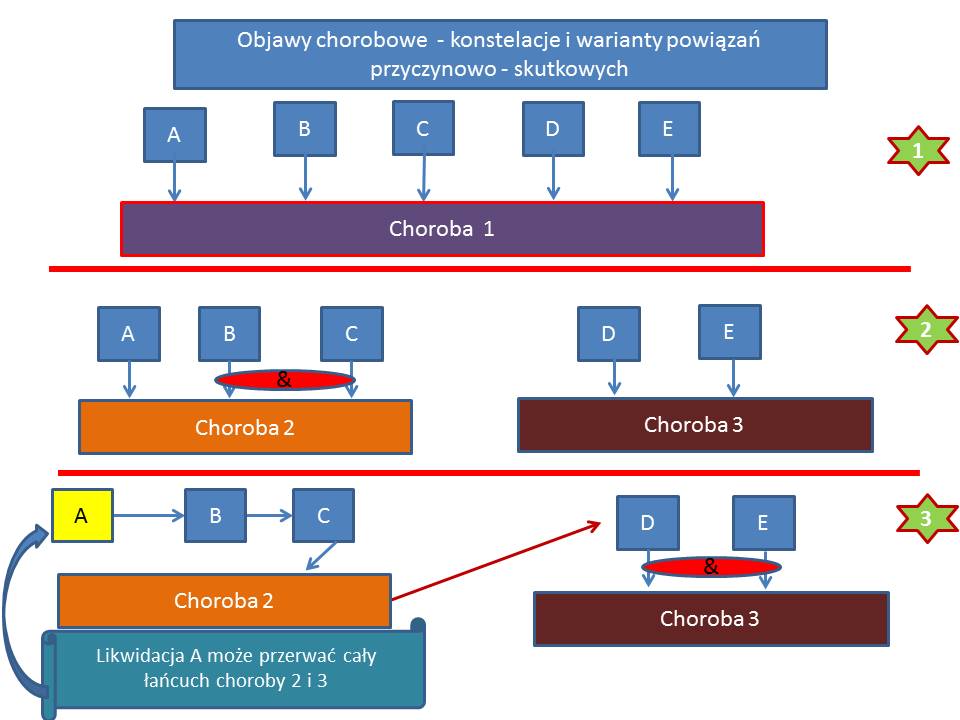
Kolejnym problemem jest zapoznanie się z licznymi objawami i zdecydowanie się, czy są one skutkiem jednej choroby, czy kilku (a nawet kilkunastu) występujących jednocześnie. Następnie z tego ogromu danych należy wybrać objawy główne. Z doświadczenia wiem, że nie jest to łatwe zadanie.
Problem komplikuje sytuacja, gdy objawy zgłaszane są z różnych narządów – czyli są “rozproszone” (np. ze strony serca, brzucha i głowy).
Powstaje wtedy dylemat, czy są to zaburzenia psychiczne, somatyczne, czy psychosomatyczne.
Jak sobie radzą z problemem dużej liczby rozproszonych objawów?
“Prostą” analizę rozpoczynam od wybrania dolegliwości głównych i ustalam obszerną listę możliwych rozpoznań. Następnie łączę objawy w jeden pakiet analityczny i szukam chorób, które mogłyby mieć wszystkie objawy jednocześnie. Porównuję listę chorób pojedynczych objawów z listami zbiorczymi. Szukam najbardziej prawdopodobnych jednostek dla mojego pacjenta (w kontekście całego wywiadu – w tym socjalnego). Takie podejście pozwala mi ustawić szeroką listę diagnostyczną i nie pominąć rzadkiej choroby. Zarzucam dużą “sieć” z drobnymi oczkami w “wielkim morzu chorób (a jest ich ponad 55 tysięcy).
W przypadku licznych i rozproszonych objawów kumuluję je w “pakiety narządowe” i dopiero rozpoczynam szukanie chorób w wyżej opisany sposób. Wygląda to tak, jakbym miał kilka “sieci” z drobnymi oczkami, ale każda ma otwory odpowiedniej wielkości i kształtu dla danego rodzaju “ryb”. Kolejnym krokiem jest umieszczenie tych list w Excel i usunięcie duplikatów rozpoznań. Powstaje szeroka lista chorób, które może mieć pacjent. Niestety takich chorób może być nawet kilkaset. pacjentom przedstawiam pełną listę chorób. Do mnie należy wybranie kolejności w jakiej te choroby będą diagnozowane (w zależności od już wykonanych badań i prawdopodobieństwa wystąpienia danej choroby u pacjenta). W tej metodzie mimo wszystko są też słabe punkty, ponieważ znane mi obecnie istniejące bazy do diagnostyki różnicowej chorób maksymalnie do 20 tysięcy jednostek. Zwykle tez nie obejmują chorób genetycznych. trzeba wówczas przeszukiwać sieć Orphanet.
Reasumując, brak rozpoznania chorób u “trudnych” pacjentów może wynikać z czasochłonności analizy i złożoności problemów, które trzeba rozwiązać. System opieki zdrowotnej jest słabo przygotowany na takich pacjentów.
Wygląda to mniej więcej tak:
Pacjent szuka informacji w internecie i próbuje samodzielnie postawić rozpoznanie. Zachowuje się jak wędkarz, który za pomocą wędki łowi po jednej przypadkowej rybie. Może to trwać całe jego życie i nie znajdzie rozpoznania.
Kolejny etap to lekarz POZ. Wychodzi na pomost i zarzuca sieć z dużymi oczkami. Szuka najczęstszych i najbardziej prawdopodobnych chorób, które wymagają kosztownej diagnostyki. Powiedzmy, ze tych chorób jest około 2 tysięcy. Takie postępowanie również może spowodować, że do końca życia nie postawi się rozpoznania rzadkiej lub nietypowej choroby.
Lekarze specjaliści -ci- już wsiadają do swojej łódki (w klinikach – do kutra), odpływają dalej od brzegu zarzucają w morzu sieć z mniejszymi oczkami, ale są one o odpowiednim kształcie w zależności od specjalizacji. Efektem tego może być przeszukanie do 5 tysięcy chorób – z tym, że trzeba by odwiedzić 10 różnych specjalistów chętnych do prowadzenia pogłębionej analizy i jednocześnie dysponujących specjalistycznym wsparciem informatycznym, aby zbadać 55 tysięcy. W tej ścieżce – rozpoznanie (przy odrobinie szczęścia) może postawi się po kilku latach.
Diagnostyka trudnych przypadków i ośrodki chorób rzadkich. Na tym etapie istnieje możliwość poświęcenia więcej czasu na analizę i interdyscyplinarne różnicowanie objawów chorób pacjenta (na przyjęcie czeka się czasem rok). Na tym polu działają tu już zespoły specjalistów, lub lekarzy tacy jak ja i np. prof,dr Jürgen Schäfer – w Niemczech) – przygotowani mentalnie, analitycznie, informatycznie i sprzętowo do podejmowania się trudnych wyzwań. Trzymając się nomenklatury rybackiej, wsiadamy na specjalistyczne trawlery, wypływamy na szeroki ocean i zarzucamy sieci z drobnymi oczkami. Czasem, jak w przypadku objawów rozproszonych, musimy użyć drobnych oczek, ale do tego jeszcze o odpowiednim do narządów kształcie. Diagnostyka obejmuje wiele chorób i trzeba się przygotować, że za szybkość postawienia diagnozy (eliminacji niemożliwych chorób przez ich laboratoryjne wykluczenie) niestety trzeba wiele zapłacić. (trawler i załoga kosztują znacznie więcej niż wędka). Trzeba wykonać wiele badań, w tym bardzo kosztownych.(ciężar badań przeniesiony jest na pacjenta, lub w ośrodkach chorób rzadkich ograniczany jest procedurami przez NFZ). Także one nie gwarantują szybkiego znalezienia rozpoznania. Takie szerokie podejście diagnostyczne daje jednak szansę, że w ciągu kilku miesięcy można rozpoznać rzadką lub nietypową chorobę.Szukamy kilku chorób wśród 55 tysięcy, ale narzędzia informatyczne ułatwiają to w stosunku do ich połowy (20 tysięcy). Reszta – to przeszukiwanie piśmiennictwa PubMed lub Internetu.
Z pomocą powoli zaczyna przychodzić sztuczna inteligencja i komputery typu dr Watson (IBM), rozpoznawanie obrazem i głosem. Potrzebne jednak będzie sprzężenia narzędzi diagnostyki różnicowej z szybkimi zestawami testów laboratoryjno-obrazowych lub chipów do bieżącej analizy stanu zdrowia i składu biochemicznego w naszych organizmach. 🙂
Dawki promieniowania w czasie badań diagnostycznych
W ostatnim czasie znacznie zaostrzono kontrolę dawek promieniowania, które może otrzymać pacjent w czasie badań radiologicznych i scyntygraficznych. Dlatego e-skierowania muszą być wystawiane przez centralny portal w gabinet.gov.pl
Wprowadzono prawo atomowe, które reguluje ten problem (Dz.U. 2019 poz. 1792 )
Skalę porównawczą stanowi dawka w czasie zwykłego zdjęcia
rtg klatki piersiowej =1
Dokładne wartości opisano w iRefer
Uzasadnienie i optymalizacja dawki promieniowania
Dla przykładu największe wartości promieniowania występują przy:
Badania RTG
TK Klatki piersiowej = 1000
TK Jamy brzusznej = 1100
Kolonografia TK 1100
TK klatki piersiowej, jamy brzusznej i miednicy =1400
Badania medycyny nuklearnej
PET-TK głowy (F-18 FDG)= 400
PET-TK całego ciała (F-18 FDG) =1200 (dawka jaką otrzymuje się przez 8,1 roku) naturalnego narażania się
Przeciwciała w kierunku: POTS – CFS/ME – CRPS – SFN
POTS – CFS/ME – CRPS – SFN
Nowoczesna diagnostyka w kierunku trudnych zespołów chorobowych na stronie CellTrend lab – koszt badania około 3600 zł
POTS Zespół Posturalnej Tachykardii Ortostatycznej
- Angiotensin-II-Receptor-1 (AT1R) IgG-auto-antibodies
- Endothelin-Receptor-A (ETAR) IgG-auto-antibodies
- Beta-1 adrenergic receptor auto-antibodies
- Beta-2 adrenergic receptor auto-antibodies
- Muscarinic cholinergic (M1) receptor auto-antibodies
- Muscarinic cholinergic (M2) receptor auto-antibodies
- Muscarinic cholinergic (M3) receptor auto-antibodies
- Muscarinic cholinergic (M4) receptor auto-antibodies
- Muscarinic cholinergic (M5) receptor auto-antibodies
- Alpha-1 adrenergic receptor auto-antibodies
- Alpha-2 adrenergic receptor auto-antibodies
CFS/ME – Zespół chronicznego zmęczenia, ME/CFS (inne nazwy: syndrom chronicznego zmęczenia (CFS), encefalopatia mialgiczna (ME),
- Beta-1 adrenergic receptor auto-antibodies
- Beta-2 adrenergic receptor auto-antibodies
- Muscarinic cholinergic (M3) receptor auto-antibodies
- Muscarinic cholinergic (M4) receptor auto-antibodies
Complex regional pain syndrome (CRPS)
- Alpha-1 adrenergic receptor auto-antibodies
- Beta-2 adrenergic receptor auto-antibodies
- Muscarinic cholinergic (M2) receptor auto-antibodies
Small Fiber Neuropathy (SFN)
- FGFR3 auto-antibodies
- TSHDS auto-antibodies
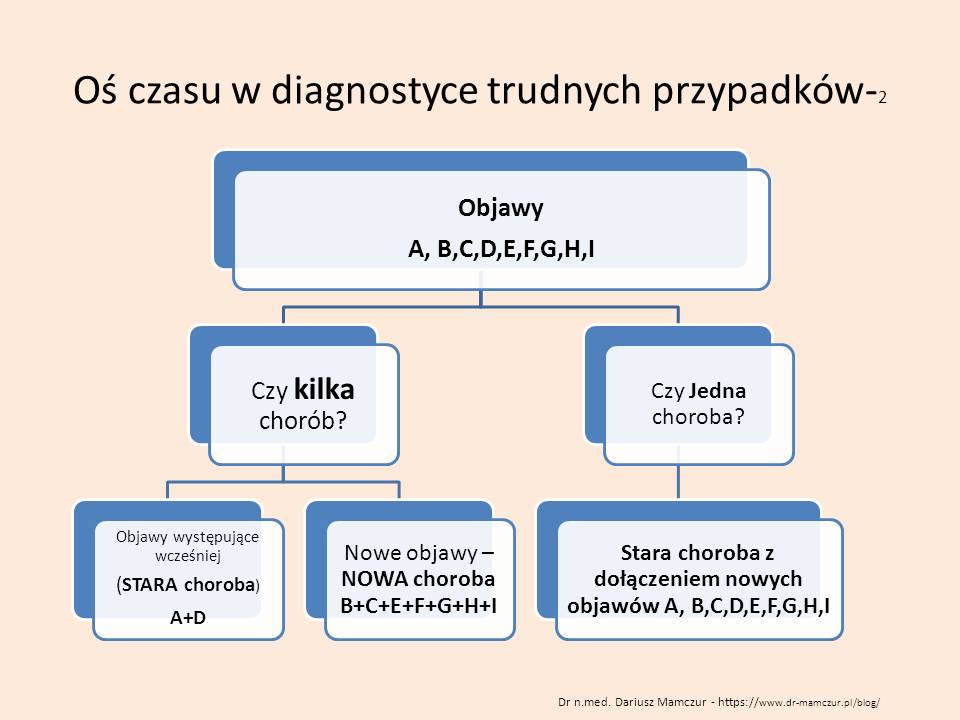
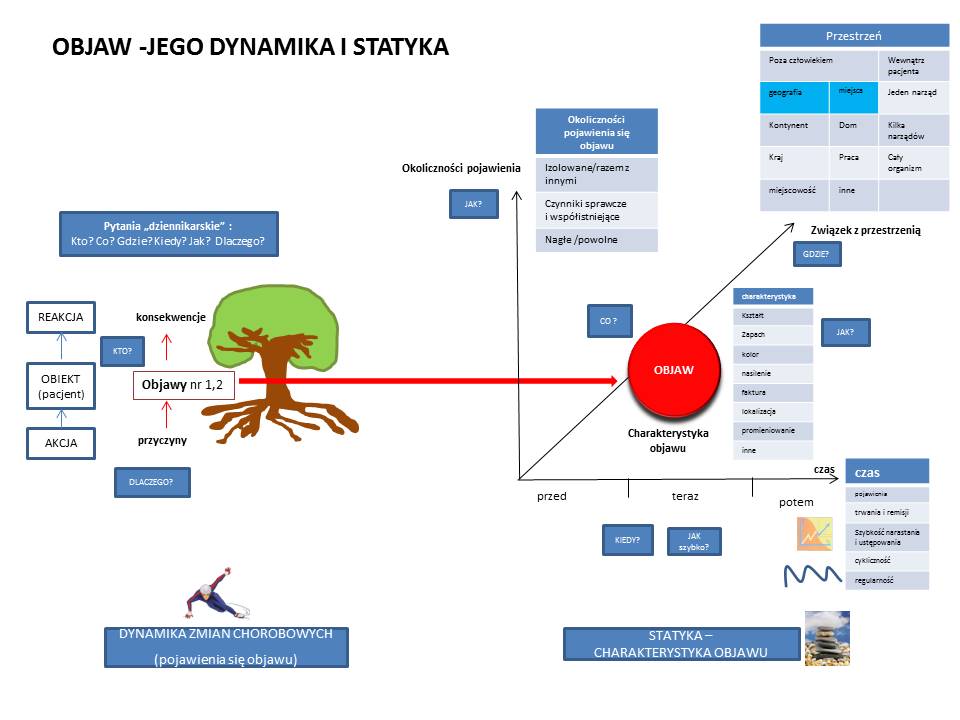
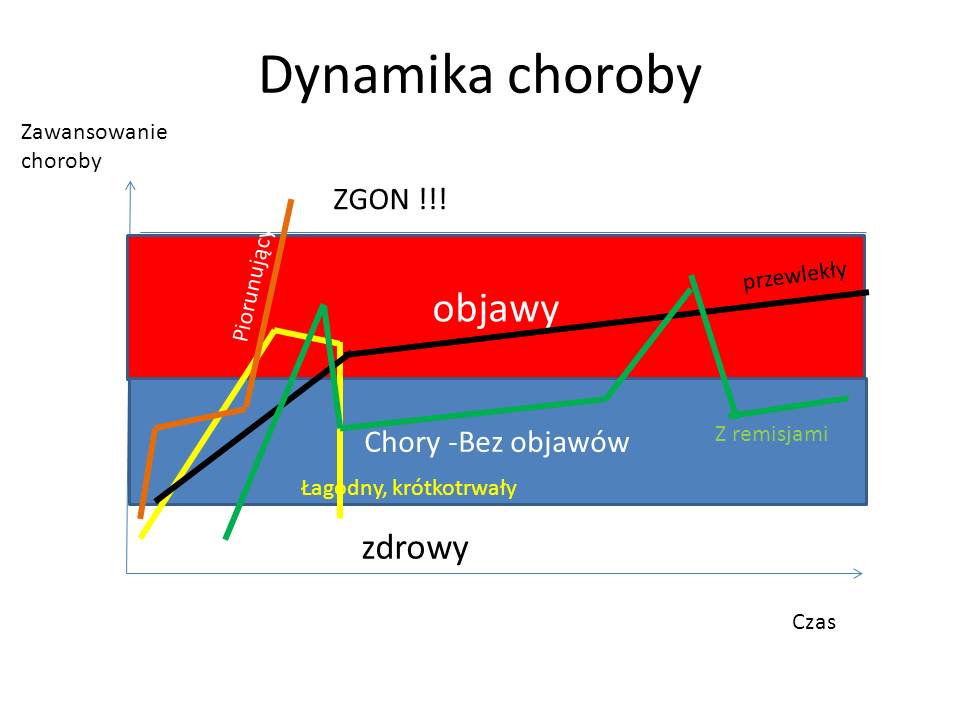
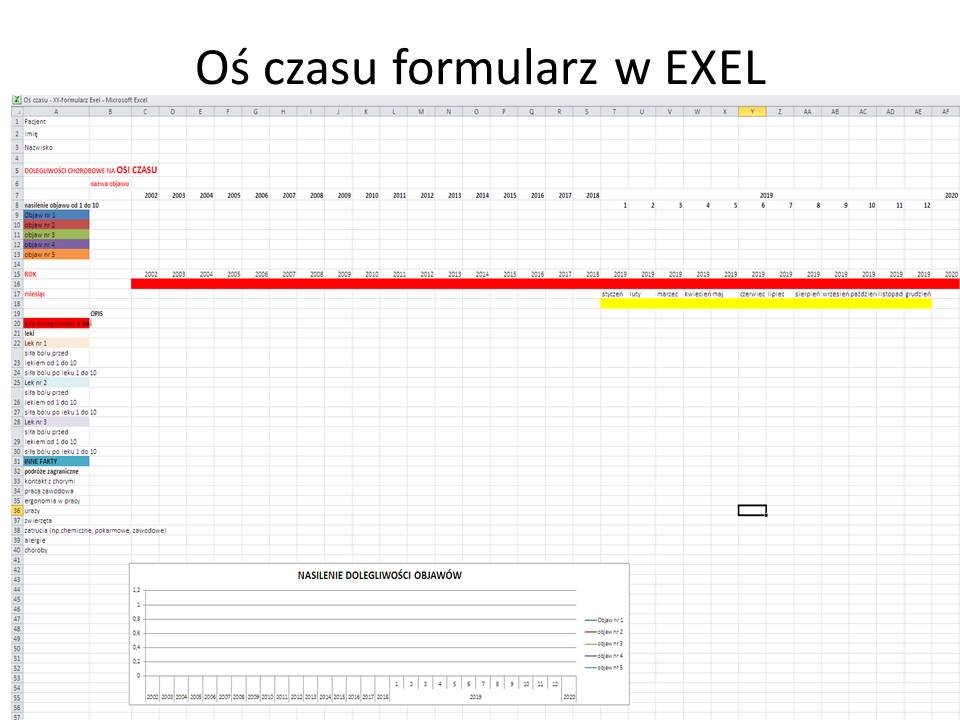
Oś czasu w diagnostyce trudnych przypadków.
Diagnostyka trudnych przypadków nieco odbiega od standardowego stawiania rozpoznania.
Zazwyczaj lekarz ma do czynienia z pacjentem, u którego rozpoznano przewlekłą chorobę lub pojawia się powszechnie znana nowa choroba. W diagnostyce możemy się skupić na nowych objawach, zakładając, że poprzednie rozpoznania były prawidłowe. Diagnostykę rozpoczyna się od wybrania objawów głównych (często jest to subiektywny wybór lekarza) i pod ich kątem stosuje się standardowe algorytmy diagnostyczne. Źle wybrany objaw główny skutkuje użyciem nieprawidłowego algorytmu, a przez to złym rozpoznaniem
Problem pojawia się, gdy dotychczasowe leczenie jest nieskuteczne. jeszcze raz zbieramy wywiad i przytłacza duża ilość (w tym bardzo rozproszonych narządowo) objawów.
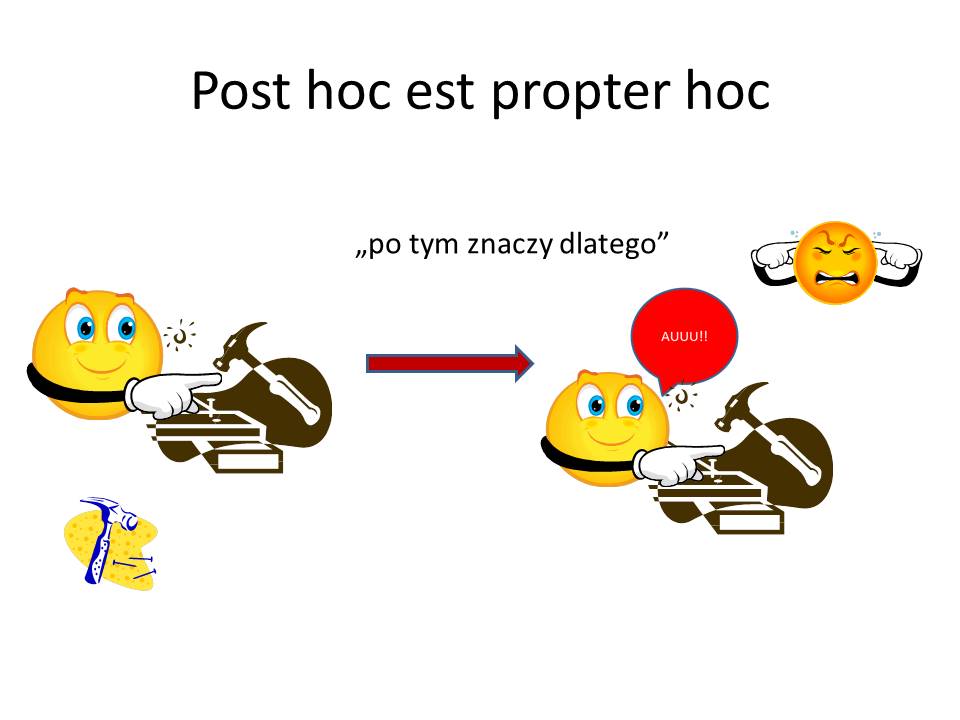
 Zastanawiamy się, czy mamy do czynienia z chorobą, która powstała na skutek jakiegoś czynnika sprawczego?
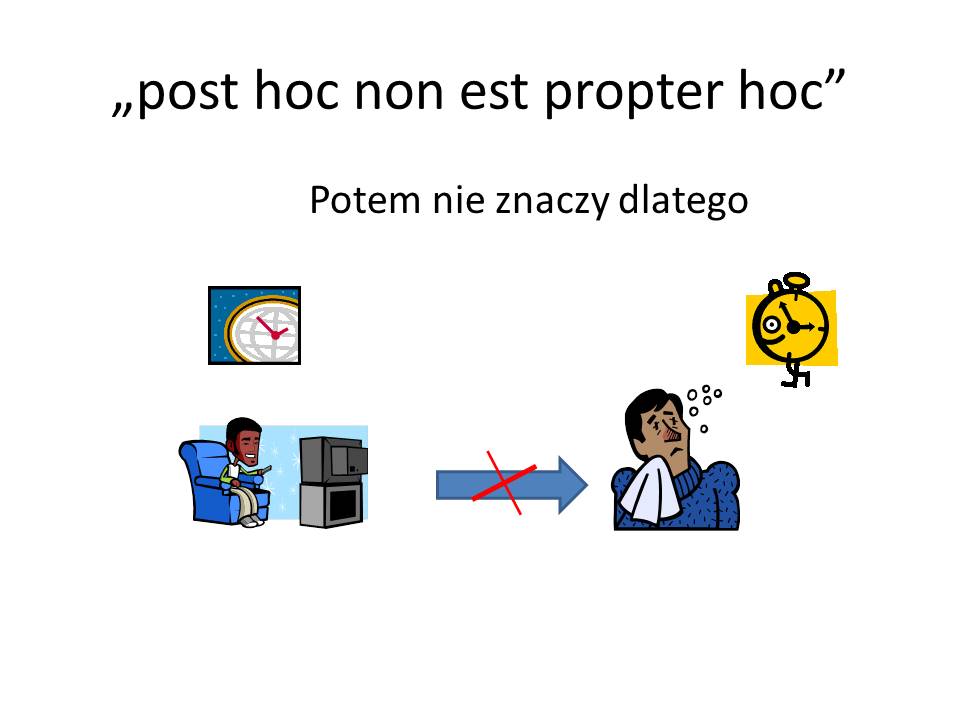
Zastanawiamy się, czy mamy do czynienia z chorobą, która powstała na skutek jakiegoś czynnika sprawczego?
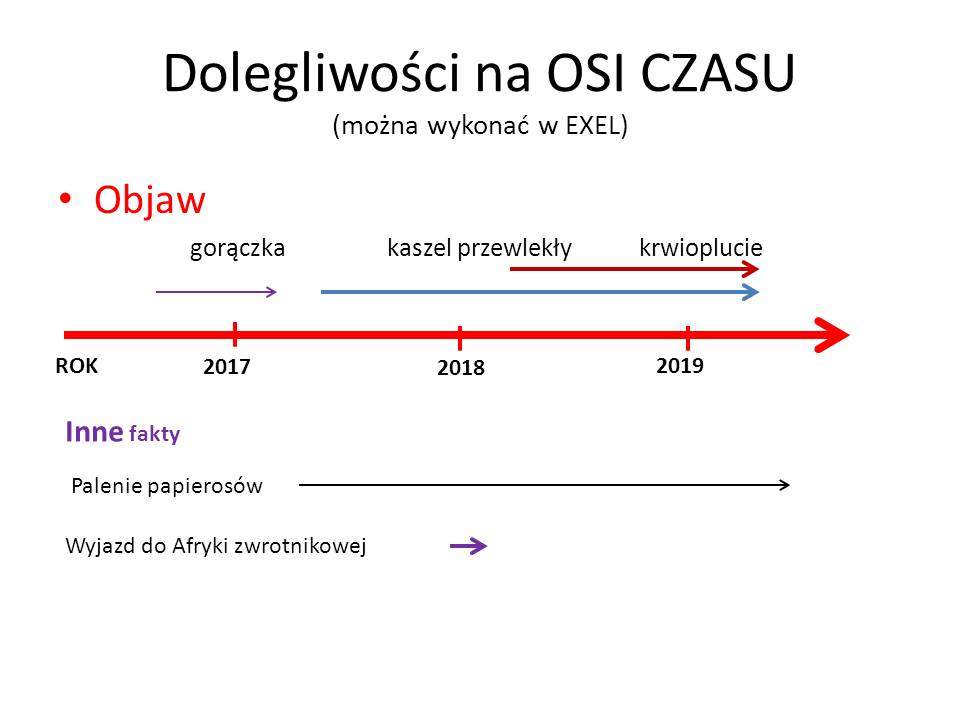
Musimy jednak uwzględnić fakt, że początek choroby przypadkowo współistniał ze znanym nam wydarzeniem z życia chorego.
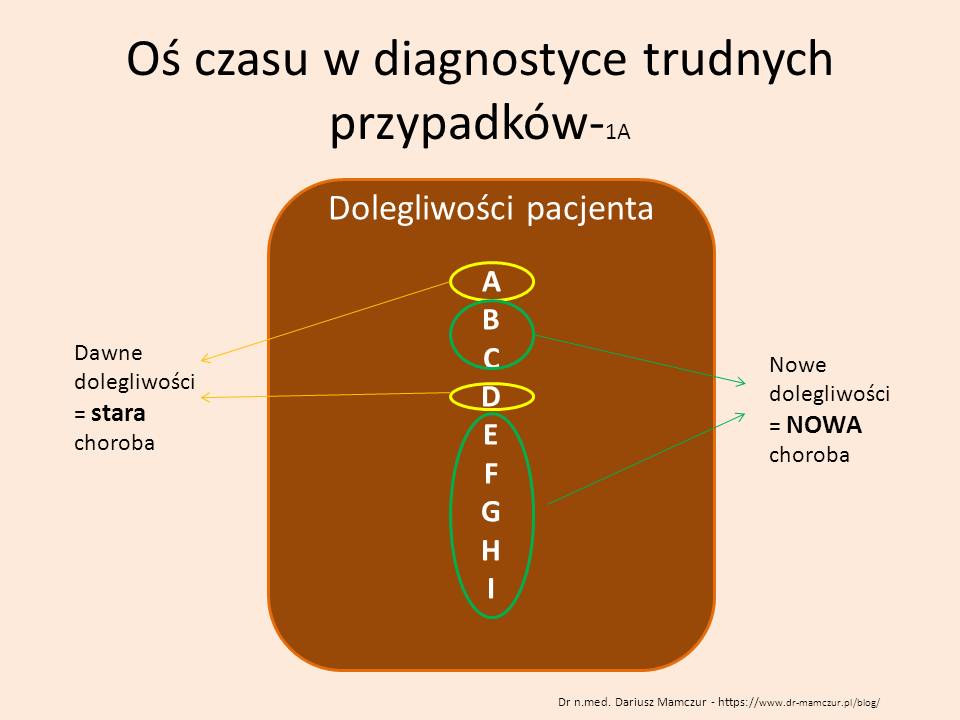
 Rozpoczynając diagnostykę różnicową stajemy przed jednym z większych dylematów, z którymi nie radzi oprogramowanie diagnostyczne oparte o sztuczną inteligencję. Pytanie brzmi: Czy objawy chorego są wywołane przez jedną chorobę, czy przez kilka chorób? Najprościej podstawić do algorytmów cały komplet objawów i szukać jednej choroby? Częściowo możemy sobie z tym poradzić eliminując objawy starej choroby i jesli mamy jeden okres pojawienia się pozostałych objawów rozpoczynać zawężoną w ten sposób diagnostykę różnicową – budując listę chorób – także w oparciu o czynnik etiologiczny (np. wyjazd do Afryki) – z powiązaniem danych socjalnych z objawami pacjenta nie radzi sobie też wiele “diagnozowarek”. Dlatego też umieszczenie dolegliwości na oso czasu może nam pomóc w ustaleniu związków przyczynowo- skutkowych choroby pacjenta, ale także ZAWĘZIĆ DIAGNOSTYKĘ RÓŻNICOWĄ
Rozpoczynając diagnostykę różnicową stajemy przed jednym z większych dylematów, z którymi nie radzi oprogramowanie diagnostyczne oparte o sztuczną inteligencję. Pytanie brzmi: Czy objawy chorego są wywołane przez jedną chorobę, czy przez kilka chorób? Najprościej podstawić do algorytmów cały komplet objawów i szukać jednej choroby? Częściowo możemy sobie z tym poradzić eliminując objawy starej choroby i jesli mamy jeden okres pojawienia się pozostałych objawów rozpoczynać zawężoną w ten sposób diagnostykę różnicową – budując listę chorób – także w oparciu o czynnik etiologiczny (np. wyjazd do Afryki) – z powiązaniem danych socjalnych z objawami pacjenta nie radzi sobie też wiele “diagnozowarek”. Dlatego też umieszczenie dolegliwości na oso czasu może nam pomóc w ustaleniu związków przyczynowo- skutkowych choroby pacjenta, ale także ZAWĘZIĆ DIAGNOSTYKĘ RÓŻNICOWĄ
Jak zrobić zdjęcie cyfrowe z kliszy RTG lub mikroskopu?
Konsultacje zdalne czasami wymagają ode mnie porównania zdjęć rentgenowskich. Obecnie większość badań uwieczniana jest w wersji cyfrowej. Pacjenci często posiadają jeszcze stare zdjęcia wykonane na zwykłych kliszach fotograficznych. Wysyłanie ich pocztą byłoby bardzo kłopotliwe. Do wstępnej oceny porównawczej starych badań nie jest niezbędna najwyższa jakość zdjęcia.
Ostatnio miałem taka sytuację. Poprosiłem więc pacjentkę o wykonanie zdjęć z klisz przy pomocy zwykłego smartfona (duża rozdzielczość). Zdjęcie należało przykleić do szyby, którą podświetlono od tyłu lampką biurkową. Wyszły świetnie (niestety nie mogę ich pokazać ze względu na ochronę tajemnicy lekarskiej).
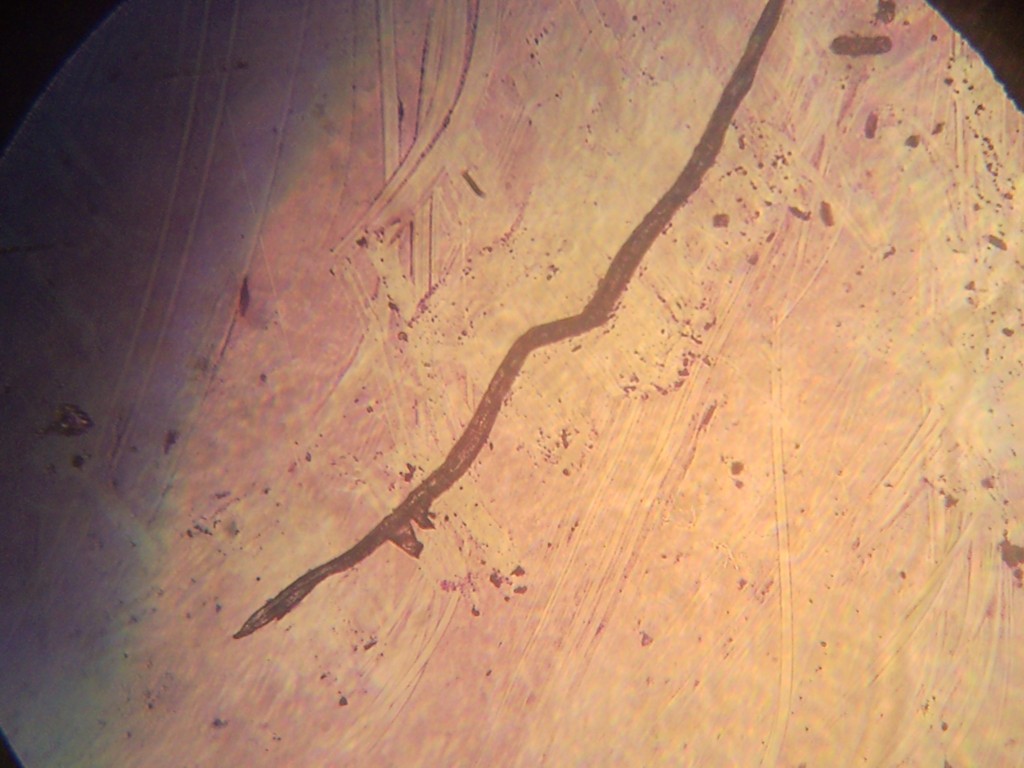
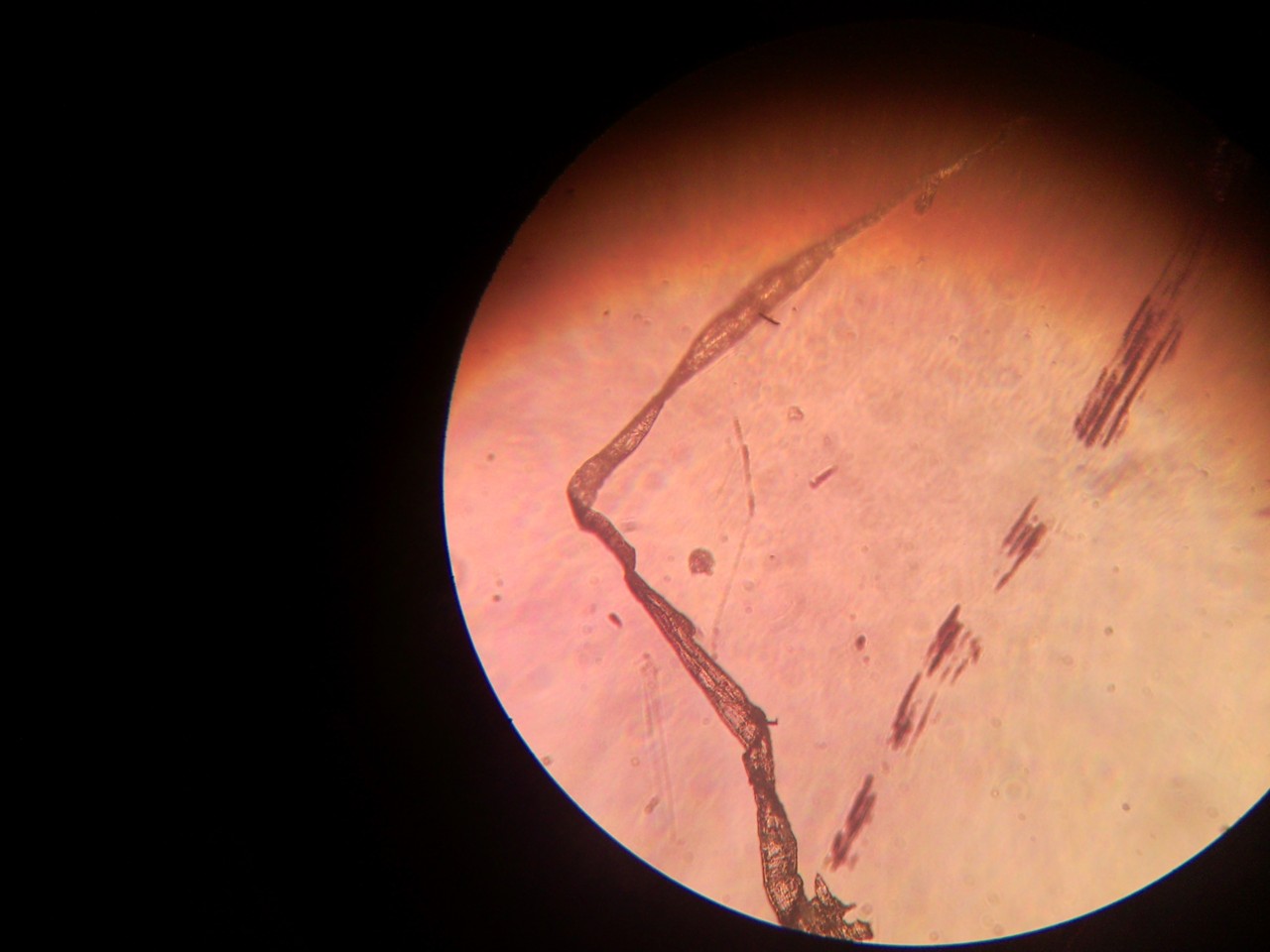
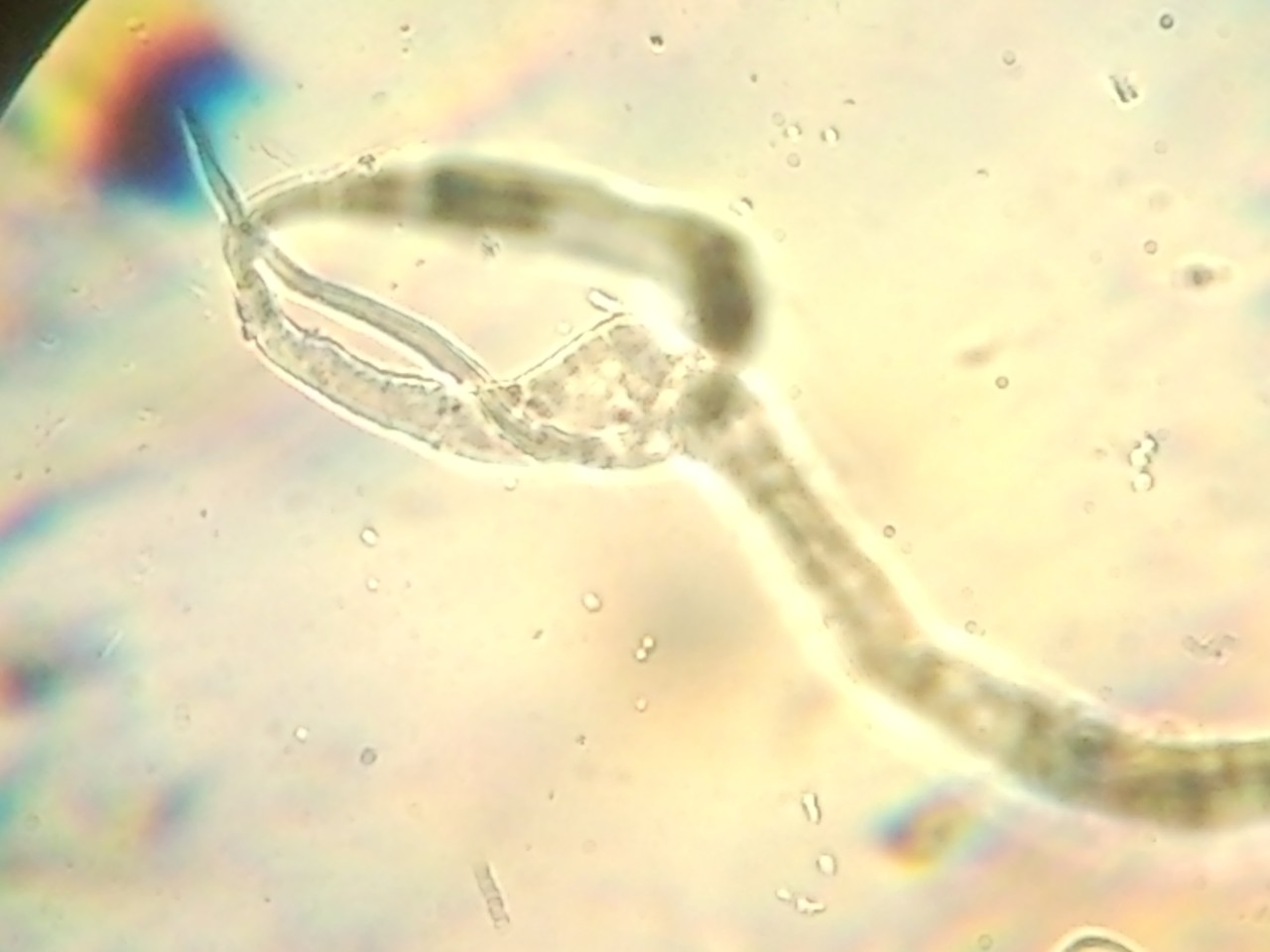
Podobną sytuację miałem wiele lat temu, gdy nie można jeszcze było kupić mikroskopów z kamerą. Podczas diagnostyki filariozy potrzebne były zdjęcia cyfrowe z mikroskopu świetlnego rozmazu krwi (gruba kropla). Czekając na uprzejmość zakładu patomorfologii pokazałem preparaty studentom mających zajęcia w laboratorium analitycznym. Jednemu ze słuchaczy bardzo się spodobał obraz z mikroskopu. Bez namysłu wyją telefon komórkowy, zbliżył do okularów mikroskopu i zrobił zdjęcie – świetne zdjęcie cyfrowe. Można je było wysłać na konsultacje we Włoszech, Niemczech i w Indiach. W ten sposób zyskałem nowe narzędzie diagnostyczno – konsultacyjne. W filariach ma to duże znaczenie, ponieważ krew do badań powinno się pobierać w godzinach nocnych (czyli w czasie, gdy większość laboratoriów nie pracuje).
Eksperci mieli rozbieżne zdanie, czy jest to filaria. Pomocne są wówczas testy immunologiczne lub PCR. Ciekawostką jest to, że ten tropikalny nicień jest nieco podobny do naszej toksokarozy. Ważne jest, że w chwili obecnej każdy z dostępem do zwykłego mikroskopu świetlnego i ze smartfonem może przygotować zdjęcia do zdalnej konsultacji.