W dniu odbyło się 28.10.2023 odbyło się online Forum Współpracy Diagnostycznej zorganizowane przez Fundacje Niezdiagnozowani.
Jednym z tematów była diagnostyka genetyczna w rozpoznawaniu chorób rzadkich i niezdiagnozowanych.
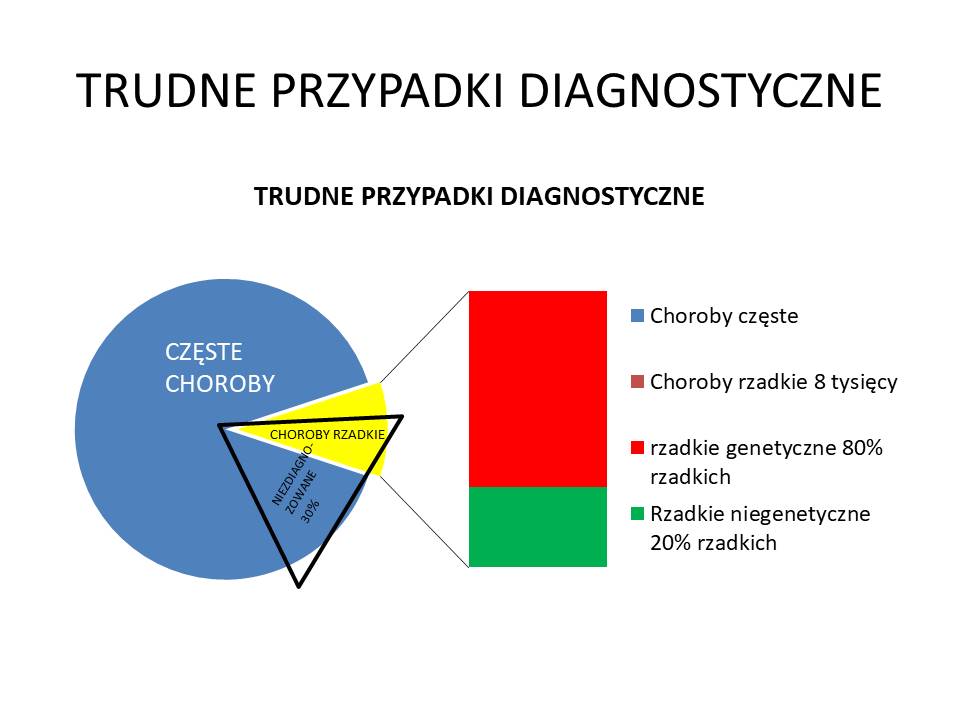
Zakładając, że około 30% (dane szacunkowe) wszystkich z ok. 55 000 (? podaje się różne liczny w ICD10) chorób nie jest rozpoznawanych, to oznacza, że około 17000 chorób nie jest zdiagnozowanych). Może to być efektem błędów diagnostycznych lub trudnościami diagnozowania chorób rzadkich.
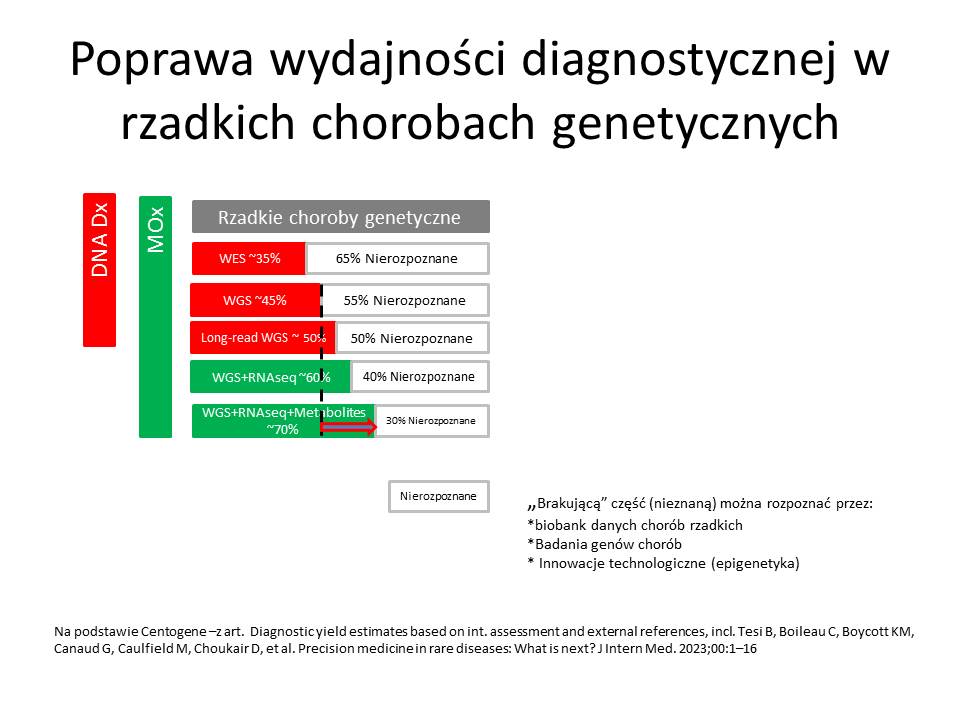
W puli chorób częstych i rozpoznawanych znajdują się także choroby uwarunkowane genetycznie (nie potrafię określić ile to chorób), natomiast wśród ok. 7000 chorób rzadkich ok. 80% to choroby uwarunkowane genetycznie – czyli ok. 5600 chorób). Zakładając, że rozpoznaje się testami genetycznymi WES ok. 35% (a droższym testem WGS około 50%) tych chorób – to nie będziemy w stanie przy teście WGS rozpoznać 2800 chorób uwarunkowanych genetycznie. (W teście WES nie rozpoznany 3640 chorób)
Z tych założeń można więc przyjąć, ze wśród 17000 nierozpoznanych chorób jest 2800 chorób genetycznych (co stanowi ok. 16,5% chorób nierozpoznanych).
Wyniki te możemy poprawić poprzez stosowanie testów MOx2 (wzrost wykrywalności do 70% chorób genetycznych), czyli nierozpoznane pozostałoby 30% z 5600 chorób tj. 1680 chorób (co stanowiłoby 9,88% z 17000 chorób niezdiagnozowanych) – czyli wzrost rozpoznawalności wyniósłby 6,6% (1120 chorób).
Procentowy udział nierozpoznanych testem WGS chorób genetycznych do wszystkich chorób wynosi 5%, natomiast przy teście MOx 2 to 3,05%.
Pojawiają się pytania:
- czy w testach przesiewowych w trudnych przypadkach diagnostycznych stosować testy genetyczne? (szukamy tą metoda około 10% wszystkich chorób i to głównie rzadkich)
- Jeśli przesiewowe testy diagnostyczne – to jakie? (testy- WES, WGS, MOx2)
- Czy można stworzyć oprogramowanie do automatycznego fenotypowania pacjentów (np. graficzny skaner ciała + wywiad prowadzony przez AI) przed zlecaniem badań genetycznych celowanych
- Czy fenotypowanie jest potrzebne, jeśli mamy genowe banki danych – wystarczy porównać materiał genetyczny? Na ile może ułatwić rozpoznanie genetyczne stosowanie określenie fenotypu? (baza fenotypów – Phenomizer)(Human phenotype) (The Human Phenotype Ontology: A Tool for Annotating and Analyzing Human Hereditary Disease)
- Fenotyp oznacza zbiór cech, które opisują dany organizm. Są to cechy takie jak: zachowanie, budowa, płodność i wpływ środowiska. Wpływ ostatniej cechy na fenotyp określany jest jako plastyczność fenotypowa. Oznacza to, że pewne cechy organizmu ulegają modyfikacji w zależności od środowiska, w którym organizm żyje. Na przykład – ten sam genotyp może dać różne fenotypy – w zależności od środowiska.
- Czy wykonywać badania biochemiczne i enzymatyczne z zakresu Centogene Metebolic (bez oceny WGS – w celu obniżenia kosztów wstępnej diagnostyki?
- jakie korzyści płyną z bardziej zaawansowanych i droższych testów i jaki test genetyczny należałoby uznać za test przesiewowy, aby znaleźć jak największą ilość podejrzanych chorób genetycznych najmniejszym kosztem. (współczynnik ceny do korzyści).
Porównując orientacyjne ceny WES ok. 5000 PLN, WGS – 10000 PLN, MOx 2. ok 35000 PLN (?) należy się zastanowić, dla jaki przypadków zarezerwować badanie MOx, a które badanie powinno stać się standardem przesiewowego testu genetycznego oraz jakimi badaniami można uzupełnić w badaniu przesiewowym np. WES.
Szczegółową analizę metod stosowanych w genetyce przedstawił Pan dr n. med. Paweł Szyld.
Bardzo ciekawy artykuł znajduje się na stronie Medycyny Praktycznej -dr n. med. Marek Bodzioch, Polski Instytut Evidence Based Medicine w Krakowie, Redaktor Naczelny „Medycyny Praktycznej – Neurologii”.
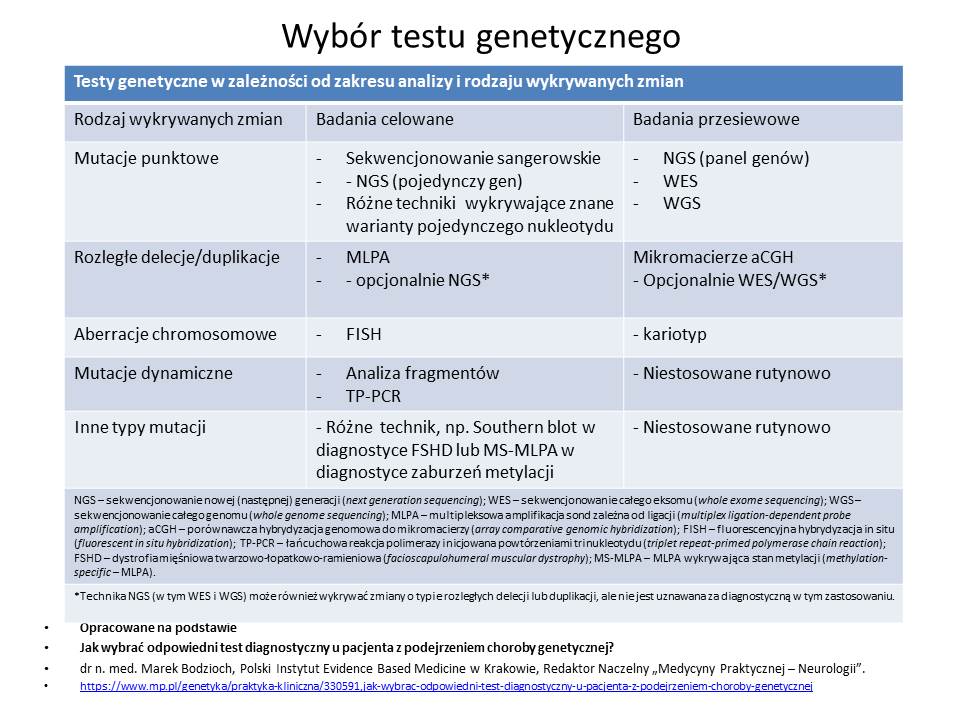
Jak wybrać odpowiedni test diagnostyczny u pacjenta z podejrzeniem choroby genetycznej?
Bardzo ładnie zestawiono w tabeli rodzaje badań genetycznych “Testy genetyczne w zależności od zakresu analizy i rodzaju wykrywanych zmian”
Choroby genetyczne człowieka to choroby, które spowodowane są zmianami w genotypie. Prowadzą one do:
- zmiany w liczbie chromosomów autosomalnych lub chromosomów płci.
- aberracje strukturalne chromosomów;
- mutacje genowe 1% [zmiany w eksonach 89%, w intronach 11%]
- Przyjmuje się, że polimorfizm stanowi 99% zmian genetycznych, mutacje zaś zaledwie 1%.)
Wady genetyczne wieloczynnikowe spowodowane czynnikami genetycznymi i środowiskowymi.
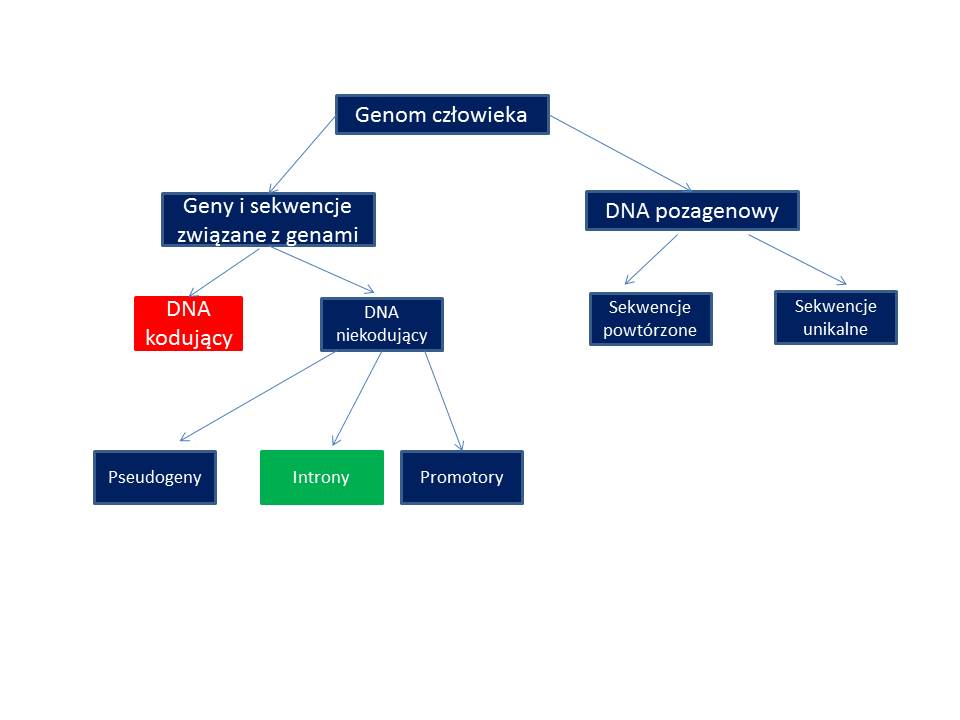
Genom – ogół materiału genetycznego (kwasu nukleinowego niosącego informację genetyczną) komórki lub organizmu. Składa się z genomu jądrowego i mitochondrialnego
Organizacja genomu człowieka i sekwencjonowanie DNA
“Kariotyp
Człowiek ma 46 chromosomów (23 pary) w jądrze każdej komórki, zorganizowane w 22 pary autosomalne i 1 parę płciową (XY mężczyzna i XX kobieta)
Każdy chromosom składa się z 2 chromatyd (tzw. siostrzanych), połączonych ze sobą w rejonie centromeru.Chromosomy są zbudowane z trzech podstawowych struktur, którymi są DNA, białka histonowe oraz białka niehistonowe. Chromosomy składają się z 2 identycznych cząsteczek DNA (2c), powstałych w wyniku replikacji, tak więc każda z 2 chromatyd zawiera taką samą informację genetyczną.
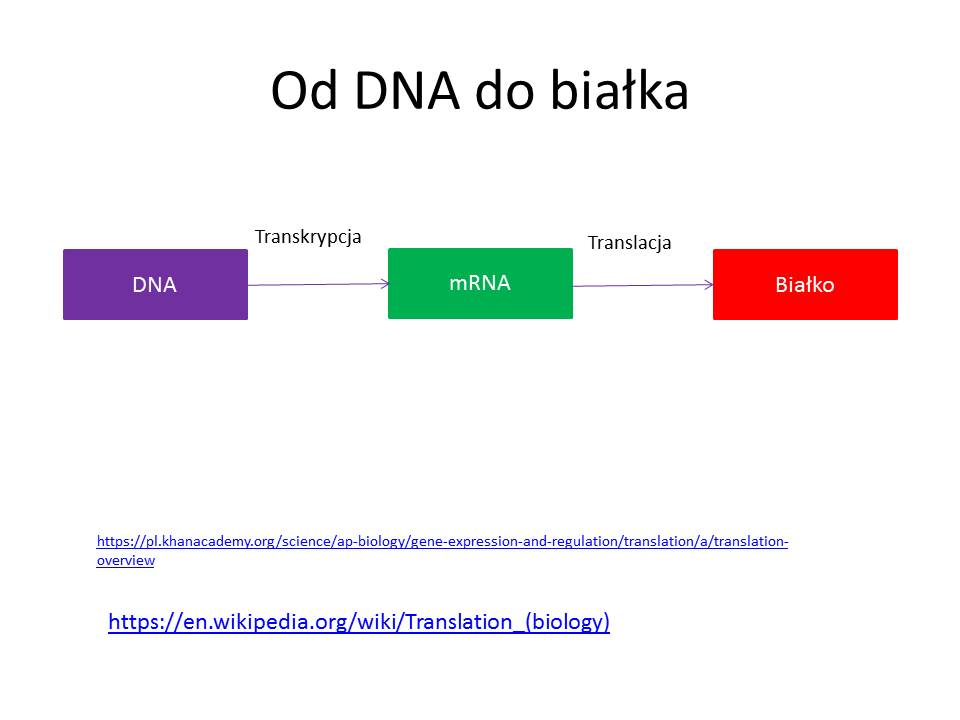
Kwas dezoksyrybonukleinowy (DNA) zbudowany jest z liniowo ułożonych czterech typów nukleotydów: adeninowego, tyminowego, cytozynowego i guaninowego. Tworzą one dwie nici przeciwlegle biegnące, połączone ze sobą wiązaniami wodorowymi w taki sposób, że adenina, będąca składnikiem nukleotydu adeninowego jednej nici, łączy się z tyminą drugiej nici dwoma wiązaniami wodorowymi, guanina zaś z cytozyną – trzema wiązaniami wodorowymi. Sekwencja nukleotydów, czyli ich kolejność w łańcuchu DNA, tworzy informację genetyczną mówiącą o kolejności aminokwasów składających się na białko kodowane przez dany gen.
Genom człowieka składa się z trzech miliardów liter DNA kodujących geny, które odgrywają kluczową rolę w tworzeniu nas takimi, jakimi jesteśmy.
Genom to zapisane w formie chemicznej podstawowe informacje dotyczące budowy i funkcjonowania naszego organizmu. Ludzki genom składa się z około 30 000 genów, z czego 20–25 000 koduje białka.
Kariotyp ocenia się pod mikroskopem
Kariotypowanie jest wykorzystywane do poszukiwania nieprawidłowej liczby lub struktury chromosomów. Kiedy ktoś wykonuje badanie krwi, aby zobaczyć, ile ma chromosomów i czy chromosomy są kompletne, robimy zdjęcie, na którym ustawiamy wszystkie chromosomy i liczymy je. W ten sposób możemy stwierdzić, czy ktoś ma prawidłową liczbę chromosomów, która wynosi 46, a także spojrzeć na chromosomy X i Y, aby określić, czy jest to mężczyzna czy kobieta.
“Dotychczas stosowane metody diagnostyki genetycznej wykrywały tylko bardzo duże zmiany materiału genetycznego (klasyczne badanie kariotypu) lub tylko wybrane mikrodelecje i mikroduplikacje materiału genetycznego (FISH, MLPA).”
Ocena delecji/duplikacji chromosomowych
Badanie mikromacierzy (aCGH) umożliwia niezwykle dokładną ocenę chromosomów i zmian submikroskopowych, które mogą powodować zaburzenia rozwoju intelektualnego (tzw. mikrodelecje i mikroduplikacje).(najczęstsza przyczyna zespołu Down), Niewielkie ubytki delecja z nieprawnością mikrodelecja np. Altzheimera.”
Więcej na stronie Genesis – Badania genetyczne w technologii mikromacierzy
” Porównawcza hybrydyzacja do mikromacierzy (aCGH) – metoda badania, oparta na najnowszych osiągnięciach technologicznych, jest skuteczna w wykrywaniu submikroskopowych zmian genomowych – mikrodelecji i mikroduplikacji, a właśnie ten rodzaj zmian genetycznych (tzw. CNVs) jest częstą przyczyną wad wrodzonych, niepowodzeń rozrodu, niepełnosprawności intelektualnej, opóźnienia rozwoju, autyzmu i wielu innych zaburzeń.”
NGS (sekwencjonowanie nowej generacji) –
Badanie NGS umożliwia przejście on analizy niewielkich fragmentów genu tradycyjnymi metodami do zastosowania technik umożliwiających uzyskanie pełnej sekwencji wielu genów, a nawet całego genomu.
WES sekwencjonowanie całego eksomu – powoli staje się standardem genetycznym
Badania całoeksomowych WES (5% informacji genetycznego),- wykrywa 35% chorób genetycznych.
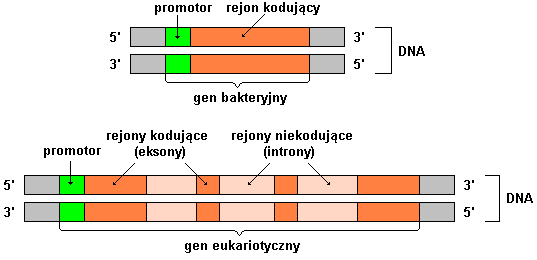
Większa część to niekodująca (nie przenosi informacji do białka) nie można przepisać informacji transkrpcji i translacji (promotory, transgeny)
WES oparte jest na sekwencjonowaniu regionów kodujących białka genów w egzomie. Egzom stanowi część genomu, tworzonego przez egzony. Ludzki genom składa się z około 180 000 egzonów. Szacuje się, że za 85% wszystkich występujących mutacji odpowiadają zmiany w egzomach.
“Korzyści badania całego egzomu:
- Identyfikacja wariantu pojedynczego nukleotydu (SNV) i zmienność liczby kopii (CNV) w regionach kodujących.
- Sekwencjonowanie i analiza genów kodujących ułatwia wykrycie podwyższonego ryzyka zachorowania na raka, co pozwala na wcześniejsze wprowadzenie działań profilaktycznych.
- Ułatwia diagnozowanie genetycznych przyczyn rzadkich zaburzeń.
- Pozwala scharakteryzować nowotwór oraz dopasować odpowiednie metody terapeutyczne.
- Badanie pomocne jest dla dzieci i osób dorosłych zmagających się z objawami zaburzeń, których przyczyny są nieznane lub niemożliwe jest zdiagnozowanie występującej choroby, która może mieć podłoże genetyczne.
- Informacje o genetycznych obciążeniach rodzinnych mogą być pomocne m.in. podczas podejmowania decyzji w kwestiach związanych ze zdrowiem czy planowania rodziny.
- Zaletą wynikającą z wyboru tego testu jest zwiększona liczba analizowanych próbek i niższy koszt niż w przypadku metod wykorzystujących sekwencjonowanie całego genomu (WGS).
- Badanie WES wraz ze wzrostem wiedzy w zakresie genów oraz chorób ustanowi dokładniejsze oraz bardziej opłacalne narzędzie diagnostyczne.
Wskazania do wykonania analizy części kodujących:
- Występowanie niekorzystnych objawów oraz trudności ze zdiagnozowaniem choroby, która może mieć podłoże genetyczne,
- Podejrzenie i pojawiające się symptomy padaczki, autyzmu, zaburzeń odporności, chorób metabolicznych,
- Zaburzenia rozwoju,
- Zanik mięśni,
- Choroby nowotworowe występujące w rodzinie,
- Schorzenia genetyczne u bliskiego członka rodziny,
- Planowanie rodziny – wynik testu pozwoli na oszacowanie ryzyka zachorowania potomstwa na chorobę wrodzoną,
- Profilaktyka zdrowotna,
- Przed wykonaniem szczepień, w celu indywidualnego ustalenia ich harmonogramu.”
WES complex jest to badanie WES o rozszerzonym zakresie. Oprócz zmian w eksonach sprawdza dodatkowo zmiany w intronach. Analiza dotyczy tylko tych zmian w intronach, których działanie jest dobrze poznane, opisane i mogą mieć znaczenie dla diagnozy pacjenta.
“Każdy z nas ma około 23 000 genów (tyle znamy obecnie), składających się z sekwencji kodujących – eksonów i sekwencji niekodujących – intronów. Eksony są już dość dobrze poznane przez naukowców – wiemy, które z nich mogą, wskutek mutacji, wywołać u pacjenta różne niepokojące objawy. Szacuje się, że mutacje w eksonach odpowiadają za większość (około 89%) znanych chorób wrodzonych. “
“Za rozwój około 11% przypadków chorób wrodzonych odpowiadają mniej znane nauce części genów, czyli introny. Zmiany w budowie intronów (tak samo jak w eksonach, mogą więc wpływać na działanie KAŻDEGO genu. Nie ma więc jednej określonej grupy chorób, dla których zmiany w intronach będą bardziej lub mniej ważne. W przypadku KAŻDEJ choroby genetycznej zmiany w intronach mogą mieć wpływ na jej przebieg, występowanie objawów, czas ich pojawienia się. Wiedza o takich zmianach wnosi więc dla każdego pacjenta bardzo istotne informacje i może zaważyć na diagnozie.”
WGS = sekwencjonowanie całego genomu – przyszłość na lepszą diagnostykę genetyk (34+10% wykrywalności)
W praktyce rzadko spotyka się nakładające się choroby genetyczne (tj. np. dwie choroby genetyczne u jednego pacjenta)
Różnice pomiędzy testem WGS i WES premium opisano na stronie “testDNA”
“Test WGS to badanie służące jedynie do celów naukowych. W trakcie badania analizowane jest całe DNA, zarówno wszystkie introny (w tym zupełnie nieznane), jak i eksony, w związku z czym dostarcza ono ogromnych ilości danych, które są niezwykle trudne w interpretacji dla naukowców. I praktycznie niemożliwe do interpretacji dla lekarzy. W badaniu WGS każdy gen jest sprawdzany niewielką liczbę razy, dlatego też na podstawie wyników testu WGS nie można postawić pewnej diagnozy. Wykonuje się je u pacjentów jedynie w skrajnie wyjątkowych przypadkach, np. gdy test WES PREMIUM nie wykazał nieprawidłowości w genach, a mimo to u pacjenta występują niepokojące objawy choroby wrodzonej.
Natomiast test WES to badanie genetyczne pierwszego wyboru, zalecane pacjentom z niepokojącymi objawami chorób wrodzonych. Test jest bardzo precyzyjny, każdy gen jest sprawdzany kilkadziesiąt razy, dzięki czemu wynik testu WES jest wartościowy dla lekarza genetyka. Standardowy test WES sprawdza jednak jedynie znane zmiany w eksonach.
Podczas gdy standardowe badanie WES analizuje eksony, badanie WES PREMIUM sprawdza dodatkowo znane zmiany w intronach, które mają istotne znaczenie dla zdrowia pacjenta”.
.
Jest to połączenie kilku gałęzi genetyki:
• Genomiki (analizy genomu)
• Transkryptomiki (określeniem miejsca i czasu aktywności genów)
• Epigenetyki (zmianami w działaniu genach wywołanymi przez czynniki zewnętrzne)
• Proteomiki (badaniem białek, ich struktury, funkcji i zależności między poszczególnymi białkami)
Lekarz genetyk zbiera Wywiad rodzinny +wywiad od pacjenta + fenotypowanie+- >przeszukuje źródła baz genetycznych i aplikacji, aby postawić rozpoznanie dla danego wariantu (bazy danych, źródła)
Fenotypowanie
“Do optymalnej współpracy z laboratorium diagnostycznym pożądane jest stosowanie kodów Human Phenotype Ontology (HPO; https://hpo.jax.org), łączących określenia i rozpoznania kliniczne ze swoistymi genami, których mutacje odnotowano u pacjentów z podobnymi objawami).”. Phenomizer
Objawami wad genetycznych mogą być:
- objawy padaczki u dzieci;
- cechy dysmorfii twarzy;
- nieprawidłowe napięcie mięśniowe;
- opóźnienie w rozwoju intelektualnym (w tym objawy ze spektrum autyzmu);
- problemy gastryczne;
- zaburzenia odporności;
- zaburzenia wzrostu.
Należy pamiętać o tym, że choroby mające objawy zbliżone do chorób wrodzonych mają podłoże genetyczne (np. zaburzenia rozwojowe dzieci – w tym. spektrum , otępienia, zaburzenia mowy mowy). Genetyk może zdiagnozować np. – płodowy zespół alkoholowy, za który odpowiadają czynniki chemiczne, środowiskowe a nie genetyczne.
Pan Marcin Kaleba z firmy Centogene omówił testy genetyczne uzupełniane badaniami biochemicznymi, enzymatycznymi CentoGene MOx 2 (opisałem je na tym blogu – badania multiomiczne). Z prezentacji można było się dowiedzieć, że spośród ponad 7000 chorób rzadkich 80% stanowią choroby uwarunkowane genetycznie. Jednak tylko około 50% z tych chorób można wykrywać za pomocą sekwencjonowania nowej generacji DNA z całego genomu (WGS). Poza standardową diagnostyką pozostało więc 50% chorób. Prezentowany test MOX 2.0 pozwala zwiększyć wykrywalność chorób genetycznych do 70% dzięki badaniu RNAseq, transkrypcj, oznaczanie metabolitów, enzymów. Czyli sposobem na poprawę skuteczności diagnostyki genetycznej jest jej rozszerzenie o badania mitochondrialne, biochemiczne i enzymatyczne. W czasie badań okazało się, że nie tylko zmiany w części eksomowej DNA (odpowiedzialnej za kodowanie białek enzymatycznych), ale także w pozostałej części genomu, w mitochondriach i zmianach biochemicznych odpowiada za choroby rzadkie.
Takie podejście zmusza do zweryfikowania testów diagnostycznych stosowanych w wykrywaniu chorób rzadkich uwarunkowanych genetycznie (wrodzonych, powstałych na skutek polimorfizmu lub mutacji. Polimorfizm jest naturalnym procesem przystosowania się organizmu do środowiska zewnętrznego (zwykle nie wywołuje chorób), natomiast mutacje mutacje indukowane są poprzez działanie szkodliwych czynników na materiał genetyczny i są zawsze niekorzystne dla organizmu.
Przyjmuje się, że polimorfizm stanowi 99% zmian genetycznych, mutacje zaś zaledwie 1%.
Polimorfizm może objawiać się w kilku postaciach (w zależności od rozległości zmian).
* polimorfizmy pojedynczego nukleotydu (ang. single nucleotide polymorphism, SNP), (Baza danych dbSNP, zawierająca ponad 11 milionów opisanych polimorfizmów SNP w genomie człowieka). (ALFA Project Release 3 with over 900M variants from >200K subjects is now available (August 3, 2023)
- delecje i insercje jednego nukleotydu w sekwencji DNA
- lub większej ilości >1000 1000 par zasad, a sięgających nawet kilku milionów nukleotydów, wariantach strukturalnych oraz zmianie liczby kopii długich fragmentów DNA (ang. copy number variation, CNV).
Źródła
WES Premium Trio – cena 9700 zł
Ekson i introny grafika – Wikipedia
źródło: Wikipedia: autor: Autorstwa real name: Karol Głąbpl.wiki: Karol007commons: Karol007e-mail: kamikaze007 (at) tlen.pl – Praca własna, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1151865